��Ƭ�ɹ��@�R��Light Sheet Fluorescence Microscopy, LSFM���ĸ���a(ch��n)����1903�꣬���˺���L�r�g���o̫��l(f��)չ���������o(j��)��ʮ���������Aʢ�D��W(xu��)��Francis Spelman����Ҟ��ˌ�С��ë��(x��)���ĽY(ji��)��(g��u)�Ͷ������������M(j��n)�ж����y�����l(f��)չ��һϵ�Ќ������������о��ˆT�ܵ�ǰ��ʹ�Â�(c��)���Ƭ�����^�����Y(ji��)��(g��u)�Ć��l(f��)���l(f��)��������ƽ��ɹ��W(xu��)��Ƭ�b�ã�orthogonal plane fluorescence optical sectioning, OPFOS�������������һ�Ϋ@�����������������ɹ�D��(1) (2) (3)�������2004������SPIM��Single plane illumination microscopy �����µİl(f��)�������M(j��n)�˹�Ƭ�@�R�İl(f��)չ��ʹ��(4)�����������{(di��o)����������̥�l(f��)���о��Č�����������o����������(j��ng)��(ji��)��(x��)�������Լ���ω��̥�l(f��)���L�r�g����ğɹ�D�� 2010���������ڵ�һ�ù�Ƭ�ɹ��@�R��ӑ��������о��߂��Q����LSFM�����@һ��@�R�Ľy(t��ng)һ���Q(5)��������m(x��)�ֳ��F(xi��n)�˺ܶ���ʽ�Ĺ�Ƭ�@�R�����������Ƭ(6)���p���Ӓ����Ƭ(7)��bessel beam(8)�������lattice(9)����ʽ��Ƭ�@�R��������@Щ����������ƹ�Ƭ�@�R�ij���ֱ������������Ⱥͳ���ҕҰ���������ڝM������W(xu��)�l(f��)չ����Ҫ��
��Ƭ�@ϵ�y(t��ng)����ԭ��
��Ƭ�@ϵ�y(t��ng)ʹ��һ�ӹ����Ę�Ʒ��(c��)�漤�l(f��)�ɹ��Ʒ����ʹ��CCD��SCMOS�M(j��n)�Йz�y����������·�͟ɹ�z�y��·���ഹֱ�����ژ�Ʒ�ܼ��l(f��)��ƽ����dz���ƽ�������������x�����l(f��)�����������Ԅӫ@�ù�W(xu��)��Ƭ���Ķ�����Ư��W(xu��)�p���������������Ƭ�@ϵ�y(t��ng)ʹ��CCD��SCMOS��������ٶ�ͨ����ÿ���ʮ���������ϰَ�����������ͨ�^�ڹ�Ƭ���ƄӘ�Ʒʹ����������l(f��)��ͬ��ƽ�棬���Ժ������ַdz��������ٵĵõ������M����3D�D���y(t��ng)���۽��ļ��l(f��)�͙z�y��ͬһ��������������^(q��)��̎�ڱ����l(f��)��B(t��i)�������]�б��z�y�ą^(q��)��(j��ng)�^�L�r�g�������ױ���������o�����C�����ӛ������������۽�ʹ���c��������ٶ������^��������
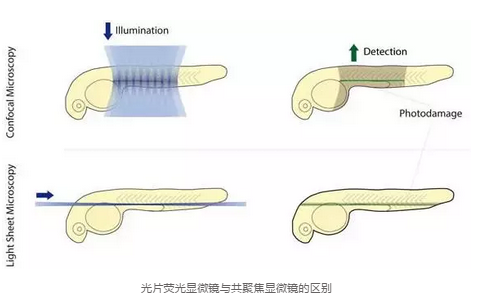
2015�꣬Leica�Ƴ����Լ��Ĺ�Ƭϵ�y(t��ng)������ԓϵ�y(t��ng)ʹ�ê��ص� TwinFlect �����R�b��ʹ���l(f��)���������҃ɂ��������䵽��Ʒ�ϣ������������������C�˼�(x��)��ˮƽ�ķֱ��ʡ������ٶȿ�������ֱ��ʸߺⶾ�Ե͵����c��ʹ��Ʒ��ԓϵ�y(t��ng)�б��������������������ɔ�(sh��)С�r������(sh��)����L�r�g���w�������B(y��ng)���������������⣬Leica��Ƭϵ�y(t��ng)�Թ��۽�����A(ch��)������Ԍ��F(xi��n)�c���۽��@�R��(li��n)��ʹ����������ɹ⼤�����������D(zhu��n)�Q�Ȳ��������m(x��)ۙ�Č�

Leica��Ƭ�@ϵ�y(t��ng)��Ҋ��(y��ng)��
-
��̥�cС������(��ģʽ������R�~�������x�����ω�ȣ�ֲ��M�Ͻ��)�l(f��)���^���еĿ������S������������磺��(x��)���w�����������K��Ѫ�ܰl(f��)�����������(j��ng)�l(f��)����������
-
���S��(x��)�����B(y��ng)������w�����[�����M�����B(y��ng)�����������B(y��ng)���r�����������
-
�Y(ji��)�Ϲ��۽����p���Ӽ����@�R���������ɹ�W(xu��)�̼��cۙ�Ĺ����������^��͌�ʽ�����`����������
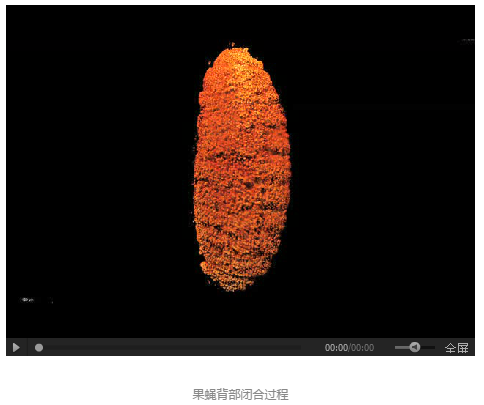
1.����3D����

2.���w�����L�r�g3D����������������ӑB(t��i)�^��

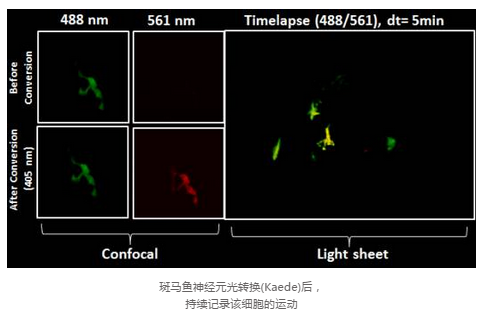
3.Ψһ���ԽY(ji��)�Ϲ��۽���Ƭ��ϵ�y(t��ng)�����F(xi��n)��W(xu��)�����ĺ��m(x��)ۙ
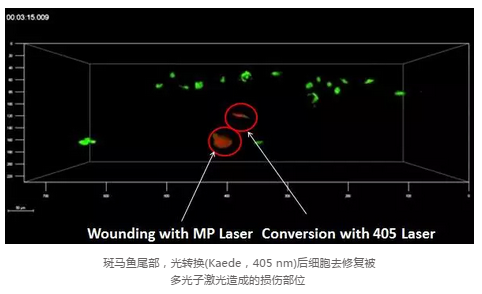

�L�r�g�ĈD��ɼ���Ҫ�S�֘�Ʒ�Ļ��������Leica��Ƭϵ�y(t��ng)�ɼ��d�����b������������Ʒ�ṩ���õ����L�l����������ֻ������������������ϵ�y(t��ng)���_���Ժܸ�����и���ɲ����Ŀ��g������
